目次
<脳表ヘモジデリン沈着症>はどんな病気?
- ✅ どんな病気か
- 🔍 原因・しくみ
- 🧠 臨床症状
- 🖥 診断のポイント
- 📋 分類・タイプ
- 🔮 経過・予後
- 📊 有病率/発生頻度のデータ
- ✅ 注目すべきポイント・解釈
- 🧭 自分が捉えるべき理解
- 🧬 主な原因
- 🔍 病理・発症メカニズムの流れ
- 🧠 なぜこの部位(小脳・聴神経など)に症状が出やすいのか?
- 🧪 具体的な背景原因例
- 🧬 遺伝性ではない理由
- 🔍 似たような「鉄沈着系疾患」で遺伝性があるものとの違い
- ⚠️ 家族に伝える際の説明のポイント
- 🧩 例外的な誤解・注意
- 🧭 まとめ
- ✅ 初期・発症期
- ➡️ 中期の進行(数年〜十数年)
- 🏁 後期・長期経過
- ⚠️ 気をつけるべきポイント・変動性
- 🧭 あなたの視点から押さえておきたい点
- ✅ 治療の主なアプローチ
- ⚠️ 治療上の注意点・限界
- 📌 実践的な治療戦略(患者・ケア者向け視点)
✅ どんな病気か
- 脳あるいは脊髄の表面(軟膜・くも膜下腔)に、長期または反復的な少量出血が起き、鉄を含む色素「ヘモジデリン」が沈着・蓄積する病態です。 国立バイオテクノロジー情報センター+2rarediseases.org+2
- 鉄の蓄積は、くも膜下腔を流れる髄液(CSF)を介して、脳・小脳・脳幹・脊髄・神経根などの表層(髄膜下・皮髄質境界)に波及することがあります。 PMC+1
- 沈着されたヘモジデリン(およびそれに伴う鉄過剰・酸化ストレス・神経細胞ダメージ)が神経変性・脱髄・萎縮を引き起こし、進行性の神経症状をもたらします。 PMC+1
🔍 原因・しくみ
- 主な原因として、くも膜下腔への慢性的または反復的な出血が挙げられます。出血源としては以下が報告されています:
- 脊髄・頭蓋内の硬膜欠損・裂隙(たとえば脊髄硬膜外・くも膜下腔からの出血) PMC+1
- 頭蓋内/脊髄手術の後遺症、外傷、神経根損傷(例:腕神経叢根損傷)など。 PMC+1
- 高齢者においては、別タイプとして大脳皮質表面の鉄沈着(皮質型 superficial siderosis)に、脳アミロイド血管症(CAA)などが関与する場合があります。 国立バイオテクノロジー情報センター+1
- 出血によって赤血球がくも膜下腔に入り、分解してヘモグロビン→ヘム→鉄が遊出します。鉄を結合・隔離しきれずに、髄液流/髄膜表面にヘモジデリンとして沈着し、神経周囲で毒性をもつと考えられています。 jamanetwork.com+1
🧠 臨床症状
代表的な症状には以下があります:
- 感音性難聴(特に高音域の聴力低下)/進行して全聴力喪失に至る場合も。 BioMed Central+1
- 小脳失調(歩行失調、バランス障害、構音障害)/特に小脳・脳幹の関与が多い。 PMC
- 病変が脊髄・神経根に及ぶと、ピラミッド路徴候(筋緊張亢進、反射亢進)/神経根症状(痛み・感覚異常)を呈することも。 国立バイオテクノロジー情報センター
- 認知・社会的機能低下が出る報告もあり、小脳・前頭葉などの萎縮が背景にあるとする研究があります。 OUP Academic
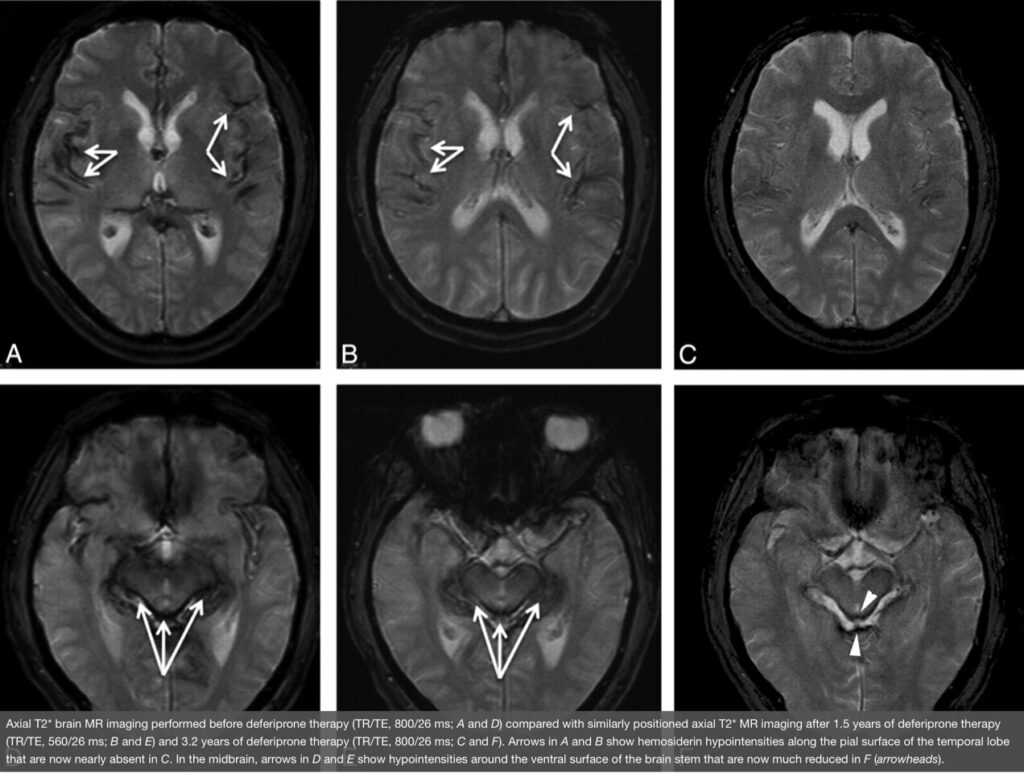
🖥 診断のポイント
- MRIが重要で、特に鉄沈着を敏感に捉えるシーケンス(SWI:susceptibility-weighted imaging/GRE:gradient-echo)が有用です。鉄沈着部分はT2*/SWIで低信号(暗く映る)になります。 PMC+1
- 出血源の同定のため、頭蓋・脊髄の全軸撮像・CT髄液造影(myelography)・硬膜裂隙の検索などを行うことがあります。 PMC
- 臨床所見+画像所見で「くも膜下腔での慢性出血+鉄沈着」が認められれば診断に至ります。出血源が見つからない「特発性(idiopathic)」例も報告されています。 Frontiers
📋 分類・タイプ
- 下小脳・後頭蓋窩型(infratentorial type, iSS):典型的なタイプで、小脳・脳幹・脊髄に鉄沈着が多く、原因として硬膜裂隙・慢性CSF漏出が多いとされます。 PMC
- 皮質型(cortical superficial siderosis, cSS):主に大脳皮質の表面に鉄沈着がみられ、特に高齢者でCAAと関連することがあります。 PMC+1
🔮 経過・予後
- 基本的には進行性・慢性の経過をたどります。鉄沈着による神経変性が可逆的ではないため、早期に出血源を制御しないと症状・萎縮が進行する可能性があります。 jamanetwork.com+1
- 出血源の手術的修復・蔓延除去が成功すれば進行が遅くなる/止まる可能性があるという報告があります。 jamanetwork.com
<脳表ヘモジデリン沈着症>の人はどれくらい?
📊 有病率/発生頻度のデータ
- 米国の患者支援団体によると、「発症率は 100万人に1人程度 」と推定されており、2024年時点で米国に診断済みのケースが約300件とされています。 rarediseases.org
- 一般人口を対象にしたスウェーデン/オランダなどの比較的古い研究では、50~69歳で約0.21%、69歳以上で約1.43% という鉄感受性MRI所見を伴った「潜在的なSS像」のデータもあります。 国立バイオテクノロジー情報センター+1
- 2025年の最新研究(英国の UK Biobank を用いた調査)では、10,305名のSWI/MRIデータをレビューし、5名が古典的な下小脳・後頭蓋窩型(infratentorial SS, iSS)と判定され、推定有病率が「100,000人あたり約 48.5人(95%CI:20.7〜113.5)」と報告されています。 SpringerLink
✅ 注目すべきポイント・解釈
- SSは「非常にまれな疾患」でありながら、MRI技術の進歩・鉄感受性撮像の普及によって、これまで想定より多く検出され始めている可能性があります。
- 「推定100万人に1人」という数値は、臨床的に明らかに症状を呈して診断されたケースを指すことが多く、「画像所見だけで発見された潜在的な症例」はもっと多い可能性があります。
- 年齢・撮像条件・出血源の有無・診断精度などによって数字が大きく変動しており、例えば高齢者(69歳以上)では0.5〜1.4%の所見を示したデータもあります。 ahajournals.org+1
- 2025年の英国調査のように「100,000人あたり約48人」という比較的高めの数値が出てきている点は、症候が軽度/無症候でも画像所見がある人を含んだ調査であるため、臨床症例数とは別軸で捉える必要があります。
🧭 自分が捉えるべき理解
- 臨床的に症状が出て診断されるレベルでは「数百万人に1人〜百万に1人程度」という極めて低頻度のまれな疾患と言える。
- ただし「MRIで鉄沈着所見あり」というレベルでは、ある程度の有病率(数十〜数百人/10万人規模)がある可能性があるという新しい知見も出ています。
- 診断が遅れやすく、「症状が進行してから診断される」「無症候/軽症で放置される」ケースも多いため、実際の有病率・発生率は報告値より高い可能性があります。
<脳表ヘモジデリン沈着症>の原因は?
🧬 主な原因
- くも膜下腔・髄液腔への慢性または反復性出血
- SS の多くは、脳・脊髄を包むくも膜・軟膜下腔に長期にわたって少量の出血(持続的/再発的)を伴っており、その血液が髄液(CSF)を通じて流れ込み、ヘモグロビン→ヘム→鉄という分解経路を経て鉄・ヘモジデリンが蓄積されると考えられています。 jamanetwork.com+3国立バイオテクノロジー情報センター+3PMC+3
- 典型例としては、脊髄硬膜裂隙・硬膜欠損(dural tear)/硬膜外・硬膜下の脳脊髄手術後/頭部・脊髄外傷/くも膜下出血後遺症などが挙げられます。 PMC+2jamanetwork.com+2
- 出血源が長期間または微量ながら繰り返されることで、鉄を含む血液成分が髄液中に供給され続け、神経表面に沈着するというメカニズムです。 Frontiers
- 出血源が明らかでない「特発性(idiopathic)」例
- 報告によれば約 35% 程度の症例で、出血源が特定できないものがあります。 国立バイオテクノロジー情報センター+1
- 特発性のケースでは、微小な硬膜裂隙や髄液漏出(CSF leak)/慢性微少出血源が隠れている可能性が議論されています。 PMC
- タイプ別の原因
- 下小脳・後頭蓋下型(infratentorial SS, iSS):主に小脳・脳幹・脊髄表面に生じ、原因として「脊髄硬膜裂隙・硬膜異常」に起因するCSF漏出や慢性出血が典型的。 PMC+1
- 皮質型(cortical SS, cSS):主に大脳皮質表面に鉄沈着をきたす型で、高齢者では 脳アミロイド血管症(CAA: cerebral amyloid angiopathy)に伴う微小出血・くも膜下出血が原因となることがあります。 国立バイオテクノロジー情報センター+1
🔍 病理・発症メカニズムの流れ
- 血液(赤血球)がくも膜下腔・髄液空間に入ると、赤血球が破壊され、ヘモグロビン→ヘム→遊離鉄が放出されます。 PMC+1
- 髄液中/髄膜表面で、グリア細胞・マイクログリア(例:ベルグマン・グリア)等がヘムオキシゲナーゼ‐1などを介してヘムを分解・鉄を隔離しようとしますが、繰り返しまたは持続出血があるとこの防御が破綻し、鉄・ヘモジデリンが沈着します。 jamanetwork.com+1
- 沈着された鉄・ヘモジデリンは 酸化ストレス を引き起こし、神経細胞・ミエリン・グリア細胞に損傷を与え、神経脱髄・萎縮・神経変性を生じます。特に小脳・脳幹・神経根・聴神経(第 VIII 脳神経)などが影響を受けやすいとされます。 国立バイオテクノロジー情報センター+1
🧠 なぜこの部位(小脳・聴神経など)に症状が出やすいのか?
- 髄液の流れ・構造的な停滞部分・くも膜下空間の形状などにより、鉄沈着が起こりやすい「表面構造」が存在します。
- 例えば、聴神経は中枢側でグリア細胞が続き、くも膜下腔・髄液空間に近接する長い神経路を有しており、鉄沈着が影響しやすいことが示唆されています。 jamanetwork.com
- 小脳被蓋・小脳虫部・脳幹表面などは、髄液‐くも膜境界/表面グリア‐髄膜に近く、沈着が目立つため典型症状(運動失調・バランス障害)として現れやすいです。 国立バイオテクノロジー情報センター
🧪 具体的な背景原因例
以下のような状況・疾患が原因として頻繁に報告されています:
- 脊髄・頭蓋内での硬膜裂隙・硬膜外/硬膜下腔の慢性CSF漏出・外傷後の硬膜修復不全。 PMC+1
- 頭蓋内/脊髄手術歴、神経根損傷(腕神経叢根損傷など)、くも膜下出血・脳動静脈奇形(AVM)・脳腫瘍(出血傾向あり)など。 PMC+1
- 高齢者で大脳皮質表面に鉄沈着を来す型では、脳アミロイド血管症(CAA)に伴う微小出血・くも膜下出血型など。 国立バイオテクノロジー情報センター
<脳表ヘモジデリン沈着症>は遺伝する?
結論から言うと——
<脳表ヘモジデリン沈着症(Superficial Siderosis, SS)>は遺伝しません。
🧬 遺伝性ではない理由
● 発症メカニズムが「後天的」だから
脳表ヘモジデリン沈着症は、くも膜下腔や脊髄の表面に慢性的な微小出血が起こり、鉄(ヘモジデリン)が沈着して神経を傷つけることで発症します。
つまり、出血という後天的な構造・外傷・血管異常が原因であり、遺伝的な変異が直接の発症要因ではありません。
(参考: NCBI Bookshelf – Superficial Siderosis of the CNS)
🔍 似たような「鉄沈着系疾患」で遺伝性があるものとの違い
| 疾患名 | 遺伝性 | 主な原因 | 鉄沈着の部位・特徴 |
|---|---|---|---|
| 神経フェリチン症 | あり(常染色体優性) | FTL遺伝子変異による鉄貯蔵障害 | 基底核・全脳性の鉄蓄積 |
| 神経デジェネレーション with 脳内鉄沈着(NBIA)群 | あり | PANK2やPLA2G6などの遺伝子変異 | 小児〜若年発症、広範な鉄沈着 |
| 脳表ヘモジデリン沈着症(SS) | ❌なし(後天性) | 慢性出血(外傷・硬膜欠損・手術・脳血管障害など) | 脳・脊髄の表面(くも膜下) |
したがって、脳表ヘモジデリン沈着症は「鉄沈着を起こす」という点ではこれらと共通しますが、遺伝子異常が原因ではないため、家族に同じ病気が出ることは基本的にありません。
⚠️ 家族に伝える際の説明のポイント
- 「これは遺伝性ではなく、血液が長期的に神経の表面に触れることで起こる病気です」
- 「家族が同じ体質・遺伝子を持っていても、発症する可能性はほぼありません」
- 「原因は、出血源(手術・外傷・硬膜欠損など)や加齢性の血管変化によるものです」
🧩 例外的な誤解・注意
- MRIで「脳表鉄沈着」が見られたとしても、それが遺伝性疾患(例:神経フェリチン症)によるものなのか、後天性出血によるものなのかを画像の分布・臨床経過・遺伝子検査で鑑別する必要があります。
- 稀に「NBIA群」や「FTL変異性疾患」をSSと誤って呼ぶことがありますが、病理学的にも別疾患です。
🧭 まとめ
| 項目 | 内容 |
|---|---|
| 原因 | 脳・脊髄の慢性または反復的出血 |
| 発症機構 | 出血→ヘモグロビン分解→鉄(ヘモジデリン)沈着→神経障害 |
| 遺伝性 | なし(後天性) |
| 家族への影響 | なし(遺伝リスクゼロ) |
| 似ているが遺伝性の病気 | 神経フェリチン症、NBIAなど |
<脳表ヘモジデリン沈着症>の経過は?
✅ 初期・発症期
- SSは、一般的に 成人中期〜後期(40代〜60代) に発症する例が多く報告されています。 国立バイオテクノロジー情報センター+2PMC+2
- 発症前に、頭部外傷・脊髄手術・くも膜下出血などの既往があるケースがしばしばあります。 jamanetwork.com+1
- 初期症状として典型的なのは以下の通りです:
- 感音性難聴(特に高音域) → 徐々に進行することが多い。 国立バイオテクノロジー情報センター
- 小脳性運動失調(歩行のふらつき、バランス障害、構音障害) PMC+1
- 頭蓋神経・脊髄根症状(手足の異常感覚・筋力低下・反射亢進)を伴うこともあります。 rarediseases.org+1
➡️ 中期の進行(数年〜十数年)
- 出血源が制御されないままだと、鉄(ヘモジデリン)がくも膜下腔・髄液空間を通じて神経表面(脳幹・小脳・脊髄表層)に蓄積し、神経変性・脱髄・萎縮が進みます。 PMC+1
- 歩行失調・バランス障害の進行、難聴の悪化、嚥下障害・構音障害(言葉の明瞭さ低下)などが見られるようになります。 国立バイオテクノロジー情報センター+1
- MRI所見としては、鉄沈着による低信号域・小脳萎縮・脊髄萎縮などが明らかになってくるケースがあります。 jamanetwork.com
🏁 後期・長期経過
- 長年にわたって進行するケースが多数あり、数十年にわたる慢性疾患として扱われることがあります。 Massachusetts General Hospital+1
- 進行すると、難聴が重度化して全聴力喪失に至る例、歩行不能・車椅子使用、日常生活動作(ADL)の低下を伴う例も報告されています。 ウィキペディア+1
- 出血源を発見・制御できた場合には進行が抑えられた/停止したという報告もありますが、既に進行した神経変性を元に戻すことは困難です。 jamanetwork.com
⚠️ 気をつけるべきポイント・変動性
- 発症から症状が出るまでに 数年〜10年以上の潜伏期間 があるケースが報告されています。 Verywell Health+1
- 同じ出血源や沈着状況でも、進行速度・症状の重さにはかなりの個人差があります。
- 出血源の手術・修復が行われた場合、進行が遅くなる可能性があるため、診断・介入のタイミングが重要です。 jamanetwork.com+1
🧭 あなたの視点から押さえておきたい点
- もしこのような病気を疑う・関わる可能性がある場合は、**「難聴+歩行失調+既往(頭部・脊髄手術・外傷)」**の組み合わせを意識しておくと早期発見につながることがあります。
- 進行性であることから、日常生活支援・リハビリ・転倒予防・聴覚補助器具の早期検討がQOL維持には重要です。
- 既存の神経変性が進んでしまった段階では、元の状態に戻すことは難しいため、「進行をいかに抑えるか」が実質的な焦点となります。
- あなたがブログ運営・基礎疾患ありという背景をお持ちなら、長期ケア設計・介護予定・生活環境整備(住環境・補助器具・聴覚サポート)などを考えておくと良いでしょう。
<脳表ヘモジデリン沈着症>の治療法は?
脳表ヘモジデリン沈着症(英:Superficial Siderosis of the Central Nervous System, SS)の治療法について、現状では根治療法ではなく「原因出血源の制御+進行抑制的支援」が中心です。以下、ご参考ください。
✅ 治療の主なアプローチ
- 出血源の同定・修復(最も重要)
- 慢性・反復性のくも膜下腔・髄液腔への出血が原因であるため、まずは「どこから出血しているか」を探す検査(例:動的CTミエログラフィー、脊髄/硬膜の裂隙・欠損所見)を行います。 国立バイオテクノロジー情報センター+2J-STAGE+2
- 出血源が判明すれば、硬膜裂隙や髄液漏出、偽髄膜腔(pseudomeningocele)などの手術修復・硬膜閉鎖・血液パッチなどの手技が行われています。 国立バイオテクノロジー情報センター+2J-STAGE+2
- このアプローチによって進行が止まったという報告もありますが、すでに神経損傷が進んでいる場合は改善は限定的です。 国立バイオテクノロジー情報センター+1
- 鉄・ヘモジデリン沈着による神経損傷への介入(補助療法的)
- 鉄キレート薬 デフェリプロン(deferiprone)は、血液脳関門を通過しうる脂溶性鉄キレート薬として研究されており、MRI上の鉄沈着低減の報告があります。 J-STAGE+2国立バイオテクノロジー情報センター+2
- ただし、臨床改善(症状改善・進行停止)との関連は十分に確立されておらず、リスク(例:好中球減少・無顆粒球症など)もあるため、現時点では“標準”治療とはされていません。 国立バイオテクノロジー情報センター+1
- 聴力低下に対しては、補聴器や場合によっては 人工内耳(コクレアインプラント)の検討もされており、聴神経/迷路の損傷度合いによって効果は変わります。 Frontiers+1
- リハビリテーション・支持療法
- 歩行失調・バランス障害・転倒リスク・聴覚障害など、神経損傷から生じる二次的側面のケアが重要です。理学療法・作業療法・言語・聴覚の専門家による介入が推奨されています。 国立バイオテクノロジー情報センター+1
- 神経変性・萎縮が進んだ状況では、日常生活支援・福祉的支援・補助器具・環境調整も検討されます。
⚠️ 治療上の注意点・限界
- 出血源を閉鎖・修復しても、既に進行してしまった神経変性・鉄沈着・萎縮は元に戻すことは難しいという点が、多くの報告で強調されています。 国立バイオテクノロジー情報センター+1
- 鉄キレート療法(deferiprone)の使用には、安全性リスク(特に好中球減少、無顆粒球症)および“効果が確実ではない”という限界があるため、慎重な検討が必要です。 国立バイオテクノロジー情報センター
- 聴力・運動機能などの症状の改善は個人差が大きく、早期介入であっても完全回復とまではいかないことが多いです。
- 出血源が不明(特発性)なケースが約30〜40%存在するため、その場合は“原因除去”ができず進行抑制に限界が出ることがあります。 国立バイオテクノロジー情報センター
📌 実践的な治療戦略(患者・ケア者向け視点)
- 出血既往(頭部/脊髄手術・外傷・くも膜下出血など)がある場合、医師と相談して「出血源検索」を早めに検討するべきです。
- 診断確定後は、専門の神経内科・神経耳科・脊髄・手術専門医と連携し“出血源修復の可否”を検討。
- 聴覚検査・歩行・バランス・転倒リスク・日常生活動作(ADL)を早期からモニタリング/介入。
- 鉄キレート療法を検討する場合は、専門医と副作用リスク(血液検査フォローなど)を含めた十分な説明の上で判断を。
- 補聴器・人工内耳・理学/作業療法・言語・聴覚・住宅環境調整など、進行予防・QOL維持のための“多職種支援”が鍵。
- 定期的なフォローアップを行い、症状の進行、転倒リスク、聴覚・運動・日常支援ニーズの変化に対応できる体制を整えておきましょう。
<脳表ヘモジデリン沈着症>の日常生活の注意点
この疾患と向き合う上で「どんな日常生活の工夫や注意があるか」を、臨床情報・患者報告をもとに整理します。あくまで一般的なアドバイスで、個別ケースについては主治医・専門医と相談してください。
✅ 毎日の生活で気をつけたいこと
- 転倒・バランス障害への備え
- SSでは「歩行失調」「バランス障害」「ふらつき」が典型症状です。 thesilentbleed.co.uk+3国立バイオテクノロジー情報センター+3uclh.nhs.uk+3
- 家の中を安全にする:手すりや滑り止めマット、夜間照明の確保、散らかった物の撤去など。
- 理学療法・作業療法の活用:バランス訓練・転倒予防訓練を専門家と協力して行う。
- 聴覚・難聴への対応
- 高音域から徐々に聴力が低下していくケースが多いです。 国立バイオテクノロジー情報センター+1
- 騒音のある場所の利用を控える/補聴器や聴覚支援機器について早めに相談する。
- 家族・職場に「難聴があります」と伝えてコミュニケーション手段を整えておく。
- 疲労・睡眠・休息の確保
- バランス機能・聴覚機能が低下すると、日常活動で余分にエネルギーを使うため疲労しやすくなります。
- 睡眠時間をしっかり確保し、無理をし過ぎず早めに休む習慣をつける。
- また、症状(ふらつき・めまい)を感じたら早めに休息をとることでリスク軽減につながります。
- 生活環境・働き方の調整
- 通勤・勤務時間・残業など、体調に対して過度な負荷になっていないか確認する。
- 自宅・職場で「踏み台・階段・長時間立ちっぱなし・揺れる移動」など危険因子がないか点検する。
- 聴覚・バランス機能の低下に対応して、必要に応じて環境(静かな席・移動補助)を調整。
- 症状の進行・変化を早期に察知する
- 新しい症状(たとえば:嚥下障害・構音障害・神経根症状・感覚異常など)が出てきたら早めに専門医に相談。 国立バイオテクノロジー情報センター+1
- 定期的に聴覚検査・歩行・バランスのチェックを行い、自分の「ベースライン(現状)」を把握しておく。
- 家族・支援者にも日常的な変化を伝えておき、「昨日よりふらつきが増えた」「新たに耳鳴りが強くなった」など小さな変化を共有できる体制をつくる。
- 医療・支援サービスとの連携強化
- 主治医・神経内科・神経耳科・リハビリ専門職など複数専門職との体制づくりが推奨されています。 国立バイオテクノロジー情報センター+1
- 補聴器・人工内耳・歩行補助具・住宅改修など、必要となったら早めに相談・導入を検討。
- 支援団体・患者会・オンラインコミュニティでの情報共有も精神的サポートになります。 thebraincharity.org.uk
🧭 あなたの状況に応じた特別な配慮(基礎疾患・生活背景をふまえて)
- あなたは「通勤あり・残業あり・週5出社」「通勤時間あり」「基礎疾患(心疾患)あり」という背景があります。
- 通勤中・階段・満員電車といった環境で「ふらつき」や「聴覚の聞き取りにくさ」が生じたら、無理せず休む・座る・途中で降りるなどの選択肢を考えておく。
- 残業後の疲労蓄積によってバランス・聴覚に悪影響が出やすいため、定時退社・休息確保・疲労管理を意識してください。
- 心疾患の観点から、転倒・バランス悪化が心臓・血管に負荷を与える可能性もあるため、理学療法・運動量を調整しながらのバランストレーニングを。
- 喫煙(1日6本)という習慣は、血管機能・酸化ストレス・神経機能にも影響を与え得ます。症状を軽くする・進行を遅らせるために減煙・禁煙も検討しておくと良いでしょう。
📋 日常生活チェックリスト(週間/月間で)
| チェック項目 | 実践内容 |
|---|---|
| 家の安全環境 | 滑り止めマット設置、手すり確認、通路物の片付け |
| 歩行・バランス | 週に1-2回バランス訓練、転倒危険時間帯の確認 |
| 聴覚チェック | 騒がしい環境で聞き取りづらさがないかチェック、補聴器相談を検討 |
| 疲労・休息 | 睡眠7時間以上確保、疲れたら早めに休む、無理な残業を控える |
| 新症状の確認 | 新たな耳鳴り、嚥下障害、構音障害、手足のしびれ・ふらつきがないか/出ていたら医師へ報告 |
| 専門医・支援サービス連携 | 定期検診・聴覚検査・リハビリ予約の確認、補助器具の要否検討 |
| 心疾患・生活習慣 | 喫煙本数記録・減煙試み、通勤・移動時の安全確保、歩きすぎ・立ちすぎ避ける |

